MV เพลง กรด- เบส ง่ายนิดเดียว ลองฟังดูน่ะ ^_^
จุดประสงค์การเรียนรู้
เนื้อหาบทเรียน

อิเล็กโทรไลต์ (Electrolyte) หมายถึง สารที่เมื่อละลายในน้ำจะนำไฟฟ้าได้ เนื่องจากมีไอออนซึ่งอาจจะเป็นไอออนบวก หรือไอออนลบเคลื่อนที่อยู่ในสารละลาย สารละลายอิเล็กโทรไลต์นี้อาจเป็นสารละลายกรด เบส หรือเกลือก็ได้ ตัวอย่างเช่น สารละลายกรดเกลือ (HCl) สารละลายโซเดียมไฮดรอกไซด์ (NaOH) และสารละลายของเกลือ KNO3 เป็นต้น โดยในสารละลายดังกล่าวประกอบด้วยไอออน H+ , Cl– , OH– , K+ และ NO3 – ตามลำดับ
นอนอิเล็กโทรไลต์ (Non-electrolyte) หมายถึง สารที่ไม่สามารถนำไฟฟ้าได้เมื่อละลายน้ำ ทั้งนี้เนื่องจาก สารพวกนอนอิเล็กโทรไลต์ จะไม่สามารถแตกตัวเป็นไอออนได้ เช่น น้ำบริสุทธิ์ น้ำตาล แอลกอฮอล์ เป็นต้น ความแตกต่างของสารอิเล็กโทรไลต์และนอน- อิเล็กโทรไลต์ พิจารณาจากสาร 2 ชนิด เมื่อละลายน้ำจะรวมกับน้ำเกิดการเปลี่ยนแปลงดังนี้

ภาพการเป็นอิเล็กโทรไลต์และนอนอิเล็กโทรไลต์ของสาร
อิเล็กโทรไลต์แก่และอิเล็กโทรไลต์อ่อน
สารละลายอิเล็กโทรไลต์ต่างๆ นำไฟฟ้าได้ไม่เท่ากัน เนื่องจากการแตกตัวเป็นไอออนของอิเล็กโทรไลต์ไม่เท่ากัน อิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้มากกว่า ก็จะนำไฟฟ้าได้ดีกว่าอิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้น้อยกว่า อิเล็กโทรไลต์แบ่งออกได้เป็น 2 ประเภท ดังนี้
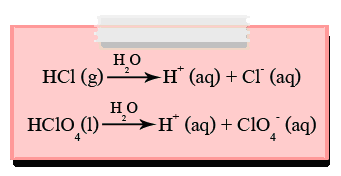
1. อิเล็กโทรไลต์แก่ (strong electrolyte) หมายถึง สารที่ละลายน้ำแล้วแตกตัวเป็นไอออนได้มาก อาจจะแตกตัวได้ 100% และนำไฟฟ้าได้ดีมาก เช่น กรดแก่ และเบสแก่ และเกลือส่วนใหญ่จะแตกตัวได้ 100% เป็นต้น
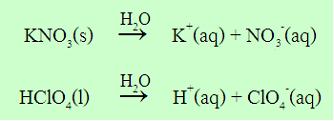
ตัวอย่างสมการแสดงการแตกตัวของสารละลายอิเล็กโทรไลต์แก่
2. อิเล็กโทรไลต์อ่อน (weak electrolyte) หมายถึง สารที่ละลายน้ำแล้วแตกตัวได้บางส่วน นำไฟฟ้าได้น้อย
ตัวอย่างสมการแสดงการแตกตัวของสารละลายอิเล็กโทรไลต์อ่อน

ตารางตัวอย่างของอิเล็กโทรไลต์แก่ และอิเล็กโทรไลต์อ่อนบางชนิด
อิเล็กโทรไลต์แก่(นำไฟฟ้าได้ดี) |
อิเล็กโทรไลต์อ่อน(นำไฟฟ้าได้ไม่ดี) |
เกลือที่ละลายน้ำทั้งหมดH2SO4HNO3HCIHBrHCIO4NaOHKOHCa(OH)2Ba(OH)2 |
CH3COOHH2CO3HNO2H2SO3H2SH2C2O4H3BO3HCIONH4OHHF |
เราจะรู้ได้อย่างไรว่าสารละลายของเราเป็นสารละลายอิเล็กโทรไลต์หรือเปล่า? อ่านเพิ่มเติม

จากการศึกษาสมบัติของสารละลาย พบว่า สารละลายกรดและสารละลายเบส เป็นสารละลายอิเล็กโทรไลต์ นำไฟฟ้าได้ เปลี่ยนสีกระดาษลิตมัส ทำปฏิกิริยากับโลหะและเกลือ กรดและเบสสามารถแตกตัวเป็นไอออน เมื่อเป็นสารละลาย เราจะศึกษาต่อไปถึงไอออนในสารละลายกรดและเบส ซึ่งทำให้สารละลายแสดงสมบัติเฉพาะตัวดังกล่าว
ไอออนในสารละลายกรด
ในสารละลายกรดทุกชนิด จะมีไอออนที่เหมือนกันอยู่ส่วนหนึ่งคือ H+ หรือ เมื่อรวมกับน้ำได้เป็น H3O+ ( ไฮโดรเนียมไอออน) ทำให้กรดมีสมบัติเหมือนกัน ตัวอย่างเช่น สารละลายกรดไฮโดรคลอริก (HCl) ซึ่งเกิดจากกรด HCl ละลายในน้ำ โมเลกุลของ HCl และ น้ำต่างก็เป็นโมเลกุลโคเวเลนต์มีขั้ว ทำให้เกิดแรงดึงดูดระหว่างขั้วของ HCl และน้ำ โดยที่โปรตอน ( H+ ) ของ HCl ถูกดึงดูดโดยโมเลกุลของน้ำเกิดเป็นไฮโดรเนียมไอออน (H+ + H2O ®H3O+) ในบางครั้งเขียนแทน H3O+ ด้วย H+ โดยเป็นที่เข้าใจว่า H+ นั้นจะอยู่รวมกับโมเลกุลของน้ำในรูป H3O+ เสมอ
(ที่มา: http://www.thaigoodview.com/node/43857)
ไฮโดรเนียมไอออนในน้ำไม่ได้อยู่เป็นไอออนเดียว แต่จะมีน้ำหลายโมเลกุลมาล้อมรอบอยู่ด้วย เช่น อาจอยู่ในรูปของ H5O2+, H7O3+ , H9O4+ เป็นต้น

จากการศึกษาสมบัติของสารละลาย พบว่า สารละลายกรดและสารละลายเบส เป็นสารละลายอิเล็กโทรไลต์ นำไฟฟ้าได้ เปลี่ยนสีกระดาษลิตมัส ทำปฏิกิริยากับโลหะและเกลือ กรดและเบสสามารถแตกตัวเป็นไอออน เมื่อเป็นสารละลาย เราจะศึกษาต่อไปถึงไอออนในสารละลายกรดและเบส ซึ่งทำให้สารละลายแสดงสมบัติเฉพาะตัวดังกล่าว
ไอออนในสารละลายกรด
ในสารละลายกรดทุกชนิด จะมีไอออนที่เหมือนกันอยู่ส่วนหนึ่งคือ H+ หรือ เมื่อรวมกับน้ำได้เป็น H3O+ ( ไฮโดรเนียมไอออน) ทำให้กรดมีสมบัติเหมือนกัน ตัวอย่างเช่น สารละลายกรดไฮโดรคลอริก (HCl) ซึ่งเกิดจากกรด HCl ละลายในน้ำ โมเลกุลของ HCl และ น้ำต่างก็เป็นโมเลกุลโคเวเลนต์มีขั้ว ทำให้เกิดแรงดึงดูดระหว่างขั้วของ HCl และน้ำ โดยที่โปรตอน ( H+ ) ของ HCl ถูกดึงดูดโดยโมเลกุลของน้ำเกิดเป็นไฮโดรเนียมไอออน (H+ + H2O ®H3O+) ในบางครั้งเขียนแทน H3O+ ด้วย H+ โดยเป็นที่เข้าใจว่า H+ นั้นจะอยู่รวมกับโมเลกุลของน้ำในรูป H3O+ เสมอ
(ที่มา : http://www.thaigoodview.com/node/43857)
ไฮโดรเนียมไอออนในน้ำไม่ได้อยู่เป็นไอออนเดียว แต่จะมีน้ำหลายโมเลกุลมาล้อมรอบอยู่ด้วย เช่น อาจอยู่ในรูปของ H5O2+, H7O3+ , H9O4+ เป็นต้น

ในการที่จะให้นิยามของกรด- เบส และในการจำแนกสารต่างๆ ว่าเป็นกรดหรือเบสนั้นได้มีนักวิทยาศาสตร์ ได้ศึกษาและตั้งทฤษฎีกรด- เบส ขึ้นหลายทฤษฎีด้วยกัน ทฤษฎีกรด- เบสที่สำคัญมีดังนี้
ทฤษฎีกรด- เบสของอาร์เรเนียส
อาร์เรเนียส เป็นนักวิทยาศาสตร์ชาวสวีเดน ได้ตั้งทฤษฎีกรด- เบส ในปี ค. ศ. 1887 ( พ. ศ. 2430) อาร์เรเนียสศึกษาสารที่ละลายน้ำ (Aqueous solution) และการนำไฟฟ้าของสารละลายนั้น เขาพบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน เมื่อละลายอยู่ในน้ำและให้นิยามกรดไว้ว่า
“กรด คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน” เช่น
“ เบส คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน” เช่น

จากปฏิกิริยาของกรดกับเบสที่กล่าวถึงแล้ว ตามทฤษฎีของเบรินสเตต- ลาวรี จะเห็นว่าในปฏิกิริยาหนึ่งๆ อาจจะจัดคู่กรด- เบสได้ 2 คู่ด้วยกัน ตัวอย่างเช่น
ตัวอย่างที่ 1
 (ที่มา : http://wps.prenhall.com/wps/media/objects/602/616516/Chapter_15.html)
(ที่มา : http://wps.prenhall.com/wps/media/objects/602/616516/Chapter_15.html)
จากสมการ NH3 เป็นอิเล็กโทรไลต์อ่อนแตกตัวได้ไม่หมดเกิดปฏิกิริยาผันกลับได้ โดยปฏิกิริยาไปข้างหน้า H2O เป็นกรด เพราะให้โปรตอนแก่ NH3 ส่วน NH3 เป็นเบส เพราะรับโปรตอนจาก H2O ปฏิกิริยาย้อนกลับ NH4+ เป็นกรดเพราะ ให้โปรตอนแก่ OH– ส่วน OH– ป็นเบสเพราะรับโปรตอนจาก NH4+ นั่นเอง
ตัวอย่างที่ 2
(ที่มา: http://wps.prenhall.com/wps/media/objects/602/616516/Chapter_15.html)
จากสมการ HF เป็นอิเล็กโทรไลต์อ่อนแตกตัวได้ไม่หมดเกิดปฏิกิริยาผันกลับได้ โดยปฏิกิริยาไปข้างหน้า HF เป็นกรด เพราะให้โปรตอนแก่ HS– ส่วน HS– เป็นเบส เพราะรับโปรตอนจาก HF ปฏิกิริยาย้อนกลับ H2S เป็นกรดเพราะ ให้โปรตอนแก่ F– ส่วน F– เป็นเบสเพราะรับโปรตอนจาก H2S นั่นเอง
จะเห็นได้ว่า คู่กรด- เบสนั้นจะมีจำนวนโปรตอน (H) ต่างกัน 1 ตัว หรืออาจกล่าวได้ว่า จำนวนโปรตอนของคู่กรด จะมากกว่าโปรตอนคู่เบสอยู่ 1 ตัวเสมอ



 1) ทดสอบและอธิบายความสัมพันธ์ระหว่างค่า pH กับสมบัติความเป็นกรด – เบสของสารละลายได้
1) ทดสอบและอธิบายความสัมพันธ์ระหว่างค่า pH กับสมบัติความเป็นกรด – เบสของสารละลายได้ 2) บอกความหมายและประโยชน์ของค่า pH
2) บอกความหมายและประโยชน์ของค่า pH